국제학술지 《테라노틱스(Theranostics)》 최신호에 논문 게재
[코리아 이슈저널=김태훈 기자] 경상국립대학교 농업생명과학대학 식품공학부 홍성민 교수 연구팀이 딥러닝 기반 인공지능 기술을 활용해 알츠하이머병 치료의 새로운 가능성을 제시하는 연구 성과를 국제 저명 학술지에 발표했다.
이번 연구 성과는 JCR 상위 10% 이내(IF 13.3, JCR 3.08%)에 해당하는 《테라노틱스(Theranostics)》 최신호에 ‘딥러닝을 활용한 알츠하이머 치료용 메틸글리옥살 소거제 TP-41 발굴(Deep learning identifies TP-41 for methylglyoxal scavenging in Alzheimer's treatment)’이라는 제목으로 게재됐다.
알츠하이머병은 고령화 사회에서 가장 빠르게 증가하는 대표적인 퇴행성 뇌질환이지만, 현재 사용 중인 치료제는 증상 완화에 그치며 근본적인 치료에는 한계가 있다.
최근 연구에 따르면 알츠하이머 환자의 뇌에서는 ‘메틸글리옥살(MGO, Methylglyoxal)’이라는 독성 대사물질이 비정상적으로 축적되며, 이는 아밀로이드 베타 플라크와 타우 단백질 엉킴 등 치매의 핵심 병리를 촉진하는 주요 원인으로 지목되고 있다.
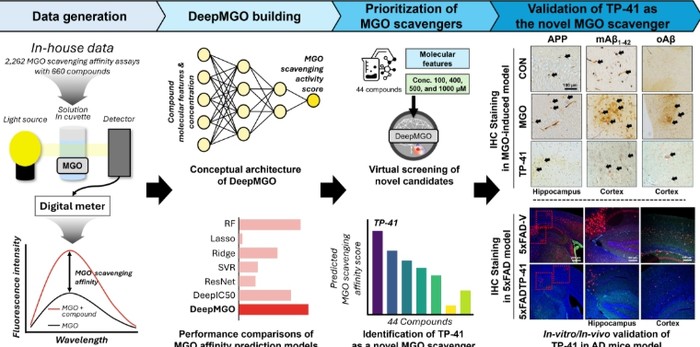
홍성민 교수 연구팀은 이러한 한계를 극복하기 위해 데이터가 상대적으로 부족한 생화학 분야에 최적화된 딥러닝 모델 ‘딥엠지오(DeepMGO)’를 독자적으로 개발했다.
딥엠지오는 소규모 실험 데이터에서도 과적합을 최소화하면서 MGO 소거 활성을 정밀하게 예측할 수 있도록 설계된 인공지능 모델로, 기존 범용 인공지능(AI) 모델 대비 예측 정확도를 크게 향상시켰다.
해당 모델을 활용한 AI 스크리닝으로 연구팀은 기존 트립토판 계열 물질보다 혈뇌장벽(BBB) 투과율이 우수한 신규 유도체 ‘TP-41’을 발굴하는 데 성공했다. TP-41은 MGO를 직접 소거하는 기전을 통해 독성을 낮추고, 뇌로의 전달 효율을 높인 것이 특징이다.
이어 진행된 동물실험에서는 TP-41의 치료 효능이 명확히 입증됐다.
유전적 알츠하이머 마우스 모델(5xFAD)과 MGO로 유도된 인지저하 모델에서 TP-41 투여 시 기억력과 학습 능력이 유의미하게 회복됐으며, 알츠하이머의 주요 원인 단백질인 아밀로이드 베타와 타우 단백질의 축적 역시 현저히 감소하는 결과가 확인됐다.
이번 연구는 식품·천연물 연구 분야에 인공지능 기술을 성공적으로 융합한 대표적 사례로 평가된다.
특히 AI 기반 신약 후보 물질을 발굴함으로써 막대한 시간과 비용이 소요되는 기존 치매 치료제 개발 과정을 혁신적으로 단축할 가능성을 제시했다는 점에서 의미가 크다.
홍성민 교수는 “딥러닝 기술을 활용해 수만 번의 실험을 거치지 않고도 알츠하이머의 원인 독소를 제거할 수 있는 유효 물질을 찾아냈다는 점이 이번 연구의 가장 큰 성과”라며 “TP-41이 향후 알츠하이머병뿐만 아니라 우울증 등 노인성 뇌질환을 아우르는 차세대 치료 전략으로 발전하길 기대한다.”라고 밝혔다.
이번 연구 성과로 고령화 사회의 난제로 꼽히는 알츠하이머병 치료에 새로운 원천기술을 제공함과 동시에, AI 기반 바이오·헬스 산업의 미래 경쟁력을 한층 강화할 것으로 기대된다.
알츠하이머 치료 신물질 TP-41 연구 성과 Q·A
Q. 이번 연구의 핵심 성과를 간단히 설명해 주십시오.
A. 이번 연구의 핵심은 데이터가 부족한 생화학 분야에 특화된 딥러닝 모델 ‘DeepMGO’를 독자적으로 개발하고, 이를 활용해 알츠하이머병의 원인 독소인 메틸글리옥살(MGO)을 효과적으로 제거하는 신규 치료 후보 물질 TP-41을 발굴하고 그 효능을 동물실험으로 입증했다는 점입니다.
Q. 메틸글리옥살(MGO)은 알츠하이머병과 어떤 관련이 있습니까?
A. 메틸글리옥살은 우리 몸의 당 대사 과정에서 생성되는 고반응성 독성 물질로, 알츠하이머 환자의 뇌에서 비정상적으로 높게 축적되는 것이 특징입니다. MGO는 아밀로이드 베타 플라크 형성과 타우 단백질 엉킴을 촉진해 신경세포 손상과 염증 반응을 유발하는 핵심 원인 물질로 주목받고 있으며, 이를 제거하는 전략은 기존 치료제와 차별화된 근본 치료 접근으로 평가됩니다.
Q. DeepMGO는 기존 인공지능 모델과 어떤 점에서 차별성이 있나요?
A. DeepMGO는 대규모 데이터가 필요한 범용 AI 모델과 달리, 소규모 생화학 실험 데이터에서도 과적합을 최소화하도록 설계된 맞춤형 딥러닝 모델입니다. 이를 통해 MGO 소거 활성을 보다 정확하게 예측할 수 있었으며, 기존 방식으로는 발견하기 어려웠던 신규 유도체 TP-41을 효율적으로 선별할 수 있었습니다.
Q. 신규 물질 TP-41의 가장 큰 강점은 무엇인가요?
A. TP-41은 기존 물질보다 혈뇌장벽(BBB) 투과율이 우수해 뇌로의 전달 효율이 높고, MGO를 직접 소거하는 기전을 통해 독성을 낮춘 것이 특징입니다. 특히 유전적 알츠하이머 마우스 모델(5xFAD) 실험에서 기억력 회복과 함께 아밀로이드 및 타우 병리가 동시에 감소하는 효과가 확인돼 치료 후보 물질로서의 가능성을 입증했습니다.
Q. 이번 연구가 갖는 사회·산업적 의미는 무엇인가요?
A. 이번 성과는 식품·천연물 연구 분야에 AI 기술을 성공적으로 접목한 대표 사례로, 치매 치료제 개발에 소요되는 시간과 비용을 획기적으로 줄일 수 있는 원천 기술을 제시했습니다. 나아가 고령화 사회의 난제인 알츠하이머병 치료에 새로운 전략을 제공함과 동시에, AI 기반 바이오·헬스 산업의 신산업 창출과 의료·사회적 비용 절감에도 기여할 것으로 기대됩니다.
주요 키워드 해설
메틸글리옥살(Methylglyoxal, MGO)
- 정의: 우리 몸의 당 대사(Glycolysis) 과정에서 생성되는 반응성이 매우 강한 독성 부산물
- 논문 내 역할: 알츠하이머병의 핵심 원인 물질로 지목됐다. 뇌세포 손상과 염증을 유발하고, 치매의 특징인 아밀로이드 베타 플라크와 타우 단백질 엉킴을 촉진하는 ‘악당’ 역할을 한다.
딥엠지오(DeepMGO)
- 정의: 홍성민 교수 연구팀이 독자적으로 개발한 ‘MGO 소거 활성 예측 딥러닝 모델’
- 논문 내 역할: 수많은 화합물을 일일이 실험하지 않고도, 컴퓨터 시뮬레이션으로 어떤 물질이 독소(MGO)를 잘 없앨지 정확히 예측해 주는 ‘탐지기’ 역할을 수행한다.
ㅇ TP-41
- 정의: DeepMGO 모델을 통해 발굴해 낸 ‘신규 화합물’
- 논문 내 역할: 이 연구의 최종 결과물(신약 후보)이다. 기존 약물보다 뇌(BBB)로 잘 전달되며, MGO를 직접 제거하여 알츠하이머 쥐의 기억력을 회복시키고 우울 증상을 개선하는 효과를 입증했다.
알츠하이머 형질전환 마우스(5xFAD)
- 정의: 5가지의 가족성 알츠하이머 유전자 돌연변이를 인위적으로 발현시켜, 심각한 치매 증상을 보이게 만든 실험용 쥐 모델
- 논문 내 역할: TP-41이 단순한 대사 스트레스뿐만 아니라, 유전적인 요인에 의한 강력한 알츠하이머 환경에서도 치료 효과가 있음을 증명하는 ‘검증대’로 사용됐다.
 |
| ▲ 연구 개념도 |
[코리아 이슈저널=김태훈 기자] 경상국립대학교 농업생명과학대학 식품공학부 홍성민 교수 연구팀이 딥러닝 기반 인공지능 기술을 활용해 알츠하이머병 치료의 새로운 가능성을 제시하는 연구 성과를 국제 저명 학술지에 발표했다.
이번 연구 성과는 JCR 상위 10% 이내(IF 13.3, JCR 3.08%)에 해당하는 《테라노틱스(Theranostics)》 최신호에 ‘딥러닝을 활용한 알츠하이머 치료용 메틸글리옥살 소거제 TP-41 발굴(Deep learning identifies TP-41 for methylglyoxal scavenging in Alzheimer's treatment)’이라는 제목으로 게재됐다.
알츠하이머병은 고령화 사회에서 가장 빠르게 증가하는 대표적인 퇴행성 뇌질환이지만, 현재 사용 중인 치료제는 증상 완화에 그치며 근본적인 치료에는 한계가 있다.
최근 연구에 따르면 알츠하이머 환자의 뇌에서는 ‘메틸글리옥살(MGO, Methylglyoxal)’이라는 독성 대사물질이 비정상적으로 축적되며, 이는 아밀로이드 베타 플라크와 타우 단백질 엉킴 등 치매의 핵심 병리를 촉진하는 주요 원인으로 지목되고 있다.
홍성민 교수 연구팀은 이러한 한계를 극복하기 위해 데이터가 상대적으로 부족한 생화학 분야에 최적화된 딥러닝 모델 ‘딥엠지오(DeepMGO)’를 독자적으로 개발했다.
딥엠지오는 소규모 실험 데이터에서도 과적합을 최소화하면서 MGO 소거 활성을 정밀하게 예측할 수 있도록 설계된 인공지능 모델로, 기존 범용 인공지능(AI) 모델 대비 예측 정확도를 크게 향상시켰다.
해당 모델을 활용한 AI 스크리닝으로 연구팀은 기존 트립토판 계열 물질보다 혈뇌장벽(BBB) 투과율이 우수한 신규 유도체 ‘TP-41’을 발굴하는 데 성공했다. TP-41은 MGO를 직접 소거하는 기전을 통해 독성을 낮추고, 뇌로의 전달 효율을 높인 것이 특징이다.
이어 진행된 동물실험에서는 TP-41의 치료 효능이 명확히 입증됐다.
유전적 알츠하이머 마우스 모델(5xFAD)과 MGO로 유도된 인지저하 모델에서 TP-41 투여 시 기억력과 학습 능력이 유의미하게 회복됐으며, 알츠하이머의 주요 원인 단백질인 아밀로이드 베타와 타우 단백질의 축적 역시 현저히 감소하는 결과가 확인됐다.
이번 연구는 식품·천연물 연구 분야에 인공지능 기술을 성공적으로 융합한 대표적 사례로 평가된다.
특히 AI 기반 신약 후보 물질을 발굴함으로써 막대한 시간과 비용이 소요되는 기존 치매 치료제 개발 과정을 혁신적으로 단축할 가능성을 제시했다는 점에서 의미가 크다.
홍성민 교수는 “딥러닝 기술을 활용해 수만 번의 실험을 거치지 않고도 알츠하이머의 원인 독소를 제거할 수 있는 유효 물질을 찾아냈다는 점이 이번 연구의 가장 큰 성과”라며 “TP-41이 향후 알츠하이머병뿐만 아니라 우울증 등 노인성 뇌질환을 아우르는 차세대 치료 전략으로 발전하길 기대한다.”라고 밝혔다.
이번 연구 성과로 고령화 사회의 난제로 꼽히는 알츠하이머병 치료에 새로운 원천기술을 제공함과 동시에, AI 기반 바이오·헬스 산업의 미래 경쟁력을 한층 강화할 것으로 기대된다.
알츠하이머 치료 신물질 TP-41 연구 성과 Q·A
Q. 이번 연구의 핵심 성과를 간단히 설명해 주십시오.
A. 이번 연구의 핵심은 데이터가 부족한 생화학 분야에 특화된 딥러닝 모델 ‘DeepMGO’를 독자적으로 개발하고, 이를 활용해 알츠하이머병의 원인 독소인 메틸글리옥살(MGO)을 효과적으로 제거하는 신규 치료 후보 물질 TP-41을 발굴하고 그 효능을 동물실험으로 입증했다는 점입니다.
Q. 메틸글리옥살(MGO)은 알츠하이머병과 어떤 관련이 있습니까?
A. 메틸글리옥살은 우리 몸의 당 대사 과정에서 생성되는 고반응성 독성 물질로, 알츠하이머 환자의 뇌에서 비정상적으로 높게 축적되는 것이 특징입니다. MGO는 아밀로이드 베타 플라크 형성과 타우 단백질 엉킴을 촉진해 신경세포 손상과 염증 반응을 유발하는 핵심 원인 물질로 주목받고 있으며, 이를 제거하는 전략은 기존 치료제와 차별화된 근본 치료 접근으로 평가됩니다.
Q. DeepMGO는 기존 인공지능 모델과 어떤 점에서 차별성이 있나요?
A. DeepMGO는 대규모 데이터가 필요한 범용 AI 모델과 달리, 소규모 생화학 실험 데이터에서도 과적합을 최소화하도록 설계된 맞춤형 딥러닝 모델입니다. 이를 통해 MGO 소거 활성을 보다 정확하게 예측할 수 있었으며, 기존 방식으로는 발견하기 어려웠던 신규 유도체 TP-41을 효율적으로 선별할 수 있었습니다.
Q. 신규 물질 TP-41의 가장 큰 강점은 무엇인가요?
A. TP-41은 기존 물질보다 혈뇌장벽(BBB) 투과율이 우수해 뇌로의 전달 효율이 높고, MGO를 직접 소거하는 기전을 통해 독성을 낮춘 것이 특징입니다. 특히 유전적 알츠하이머 마우스 모델(5xFAD) 실험에서 기억력 회복과 함께 아밀로이드 및 타우 병리가 동시에 감소하는 효과가 확인돼 치료 후보 물질로서의 가능성을 입증했습니다.
Q. 이번 연구가 갖는 사회·산업적 의미는 무엇인가요?
A. 이번 성과는 식품·천연물 연구 분야에 AI 기술을 성공적으로 접목한 대표 사례로, 치매 치료제 개발에 소요되는 시간과 비용을 획기적으로 줄일 수 있는 원천 기술을 제시했습니다. 나아가 고령화 사회의 난제인 알츠하이머병 치료에 새로운 전략을 제공함과 동시에, AI 기반 바이오·헬스 산업의 신산업 창출과 의료·사회적 비용 절감에도 기여할 것으로 기대됩니다.
주요 키워드 해설
메틸글리옥살(Methylglyoxal, MGO)
- 정의: 우리 몸의 당 대사(Glycolysis) 과정에서 생성되는 반응성이 매우 강한 독성 부산물
- 논문 내 역할: 알츠하이머병의 핵심 원인 물질로 지목됐다. 뇌세포 손상과 염증을 유발하고, 치매의 특징인 아밀로이드 베타 플라크와 타우 단백질 엉킴을 촉진하는 ‘악당’ 역할을 한다.
딥엠지오(DeepMGO)
- 정의: 홍성민 교수 연구팀이 독자적으로 개발한 ‘MGO 소거 활성 예측 딥러닝 모델’
- 논문 내 역할: 수많은 화합물을 일일이 실험하지 않고도, 컴퓨터 시뮬레이션으로 어떤 물질이 독소(MGO)를 잘 없앨지 정확히 예측해 주는 ‘탐지기’ 역할을 수행한다.
ㅇ TP-41
- 정의: DeepMGO 모델을 통해 발굴해 낸 ‘신규 화합물’
- 논문 내 역할: 이 연구의 최종 결과물(신약 후보)이다. 기존 약물보다 뇌(BBB)로 잘 전달되며, MGO를 직접 제거하여 알츠하이머 쥐의 기억력을 회복시키고 우울 증상을 개선하는 효과를 입증했다.
알츠하이머 형질전환 마우스(5xFAD)
- 정의: 5가지의 가족성 알츠하이머 유전자 돌연변이를 인위적으로 발현시켜, 심각한 치매 증상을 보이게 만든 실험용 쥐 모델
- 논문 내 역할: TP-41이 단순한 대사 스트레스뿐만 아니라, 유전적인 요인에 의한 강력한 알츠하이머 환경에서도 치료 효과가 있음을 증명하는 ‘검증대’로 사용됐다.
[저작권자ⓒ 코리아 이슈저널. 무단전재-재배포 금지]